Pelo seu uso, pilha e bateria nomes que aparentemente definem a mesma coisa, mas há uma diferença entre as duas fontes de energia.
Neste artigo, você irá descobrir os tipos de pilhas e baterias, o porquê das nomenclaturas, a origem de ambas e a diferença entre si.
Em suma, a diferença entre pilha e bateria é porque as pilhas possuem dois eletrodos e um eletrólito. Para entender essa formação, é preciso conhecer os conceitos de pilhas e baterias.
Primeiramente, vamos à origem da bateria como fonte de energia.
História
Há uma teoria que afirma que a Bateria de Bagdá foi o primeiro dispositivo a manter a corrente elétrica, entre os anos de 150 A.C. e 650 D.C. Entretanto, a interpretação de que essa foi a primeira bateria é rejeitada por muitos acadêmicos.
O termo “bateria” apareceu pela primeira vez em 1749, quando Benjamin Franklin realizava seus experimentos com eletricidade, agrupando um número de jarros que serviam como capacitores, definindo esse agrupamento como “bateria”.
Essa definição de Franklin tinha como base o fato de que multiplicar o número de recipientes daria um maior armazenamento para cargas elétricas e mais energia estaria disponível.
No entanto, a primeira bateria eletroquímica foi desenvolvida em 1800, pelo italiano Alessandro Volta. O físico uniu uma pilha de cobre (não é a pilha elétrica) com uma chapa de zinco, separados por discos de papel em salmoura, que conseguia produzir uma corrente contínua por um tempo considerável.

No entanto, Alessandro Volta não sabia que a tensão elétrica ocorria pelas reações químicas. Ele acreditava que suas células eletroquímicas eram uma fonte inesgotável de energia e os efeitos corrosivos nos eletrodos eram um mero transtorno, em vez de uma consequência inevitável da operação da bateria.
36 anos depois, o químico britânico John Frederic Daniell inventou a Célula Daniell (guarde esse nome), a primeira fonte prática de energia, se tornando um padrão na indústria e sendo adotada por redes de telégrafos elétricos.
A Célula Daniell consistia em um recipiente de cobre preenchido por uma solução de sulfato de cobre imerso em um recipiente de barro não esmaltado que continha ácido sulfúrico e um eletrodo de zinco.

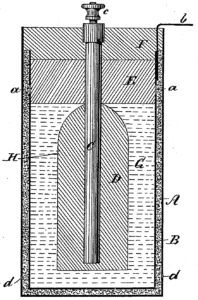
Em 1866 surge a pilha seca ácida, desenvolvida por George Leclanché, químico francês. Atualmente, essa é a forma de pilha mais comum por ser barata e de uso extenso.
Seu nome, contudo, não reflete a sua composição, pois a pilha não é seca por conter uma pasta líquida. A pilha seca ácida recebeu esse nome somente para diferenciá-la das pilhas inventadas anteriormente, como a Célula de Daniell, que usavam soluções líquidas em seus recipientes.
Princípios Químicos
Antes de chegarmos na diferença entre pilha e bateria, é necessário entender a ciência por trás desses dispositivos.
Baterias poderiam ser chamadas de conversores, pois convertem diretamente energia química em energia elétrica.
Uma bateria consiste em um certo número de células, sendo o mesmo conceito de pilha. Cada célula consiste em duas semi-células conectadas em série por um eletrolito condutor de energia que contém íons positivos, ou cátions.

Uma semi-célula inclui o eletrolito e o eletrodo negativo, por isso há a classificação dos lados positivos e negativos em pilhas e baterias.
Como o artigo é sobre diferenças, é válido destacar que há uma diferença na forma como a energia elétrica é transmitida, podendo ser via metais, óxidos ou moléculas que passam por reações eletroquímicas.
Por exemplo, a energia pode ser armazenada em zinco ou lítio, metais altamente condutores de energia. Portanto, as baterias e pilhas são fabricadas para que o fenômeno químico da oxirredução ocorra apenas quando os elétrons se movam através da parte externa do circuito.
Pilhas e baterias, desse modo, conseguem transformar a energia química dos materiais que estão em sua composição em energia elétrica. A oxirredução citada acima é a responsável por transferir os elétrons do material que passa por oxidação ao material que sofre redução, ou seja, ganha elétrons.
Assim surge a corrente elétrica armazenada em determinado dispositivo — seja pilha ou bateria — que se transmite para o aparelho eletrônico que precisa ser energizado.
Diferença entre pilha e bateria
Enfim chegamos ao assunto principal deste texto: a diferença entre pilha e bateria. Como dito no primeiro parágrafo, a diferença entre pilha e bateria é o fato de que a pilha possui somente dois eletrodos e um eletrolito.
As pilhas, aliás, também levam o nome de células eletroquímicas e seus dois eletrodos são de polos negativo e positivo. As baterias, por sua vez, são formadas por um número de pilhas, ou células eletroquímicas, ligadas em paralelo ou em série.
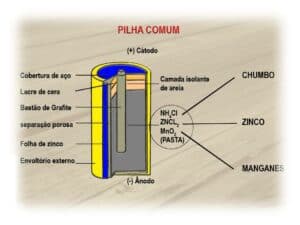
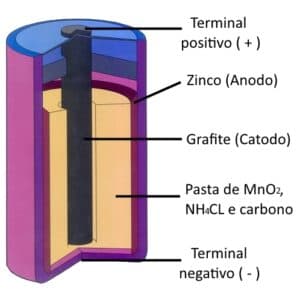
A pilha seca ácida — que também citamos na seção sobre a história da pilha —, por exemplo, usa um eletrodo negativo, sendo basicamente um revestimento de zinco, um metal doador de elétrons, e por um eletrodo positivo, sendo o que recebe os elétrons.
Com isso, constitui-se uma barra de grafita ou carvão que se insere em um tubo poroso já contendo carvão esmagado e dióxido de manganês. O eletrólito é a pasta úmida que envolve esse tubo, sendo constituído por várias formações químicas.
Assim, o eletrólito é o meio físico, sendo a solução que permite que a carga elétrica seja conduzida no interior da pilha.
A potência da pilha é baseada na tendência do eletrodo negativo em doar elétrons e do eletrodo positivo em receber elétrons.
Agora chegou a vez da bateria. Já afirmamos acima que a formação de uma bateria se dá pela ligação em série ou em paralelo de várias pilhas. Em paralelo, um polo positivo de uma pilha se conecta ao polo positivo de outra, assim como ocorre com os polos negativos.
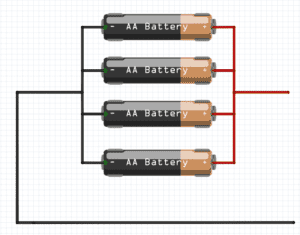
Ligadas em série, ocorre o contrário, ou seja, os polos positivos se ligam aos polos negativos e vice e versa.
Leia também: Europa aprova lei que obriga os celulares a terem bateria removível e atualizações por 5 anos
As baterias fornecem diferentes níveis de corrente e tensão elétrica, já que dependem do número de pilhas que possui. Geralmente, uma pilha comum possui tensão de 1,5 V (Volts). Assim, quando ligadas em série, as pilhas formam uma bateria de 9 V.

Existem duas classificações para pilhas e baterias: primárias e secundárias. Pilhas e baterias primárias são criadas para serem usadas até a exaustão da energia, sendo descartadas em seguida. As suas reações químicas costumam ser irreversíveis, por isso elas não recarregam sua energia.
As secundárias, obviamente, são pilhas e baterias que podem ser recarregadas, o que significa que suas reações químicas podem ser reversíveis quando a corrente elétrica é aplicada à célula. Os smartphones, por exemplo, possuem baterias secundárias.
Fonte: DigiKey










Deixe seu comentário